1、铝是地壳中含量最多的金属元素,在天然界首要以化合态方式存在于氧化铝中。铝土矿的首要成分是Al
关于以提纯某一物质为试验意图的流程题,实际上的意思便是考察混合物的除杂、别离、提纯的有关常识。当遇到这一类题时,一般的思路是仔细地在流程中找出得到的首要物质是什么,混有的杂质有哪些;仔细剖析当参加某一试剂后,能与什么物质发生反响,生成了什么产品,要用什么样的办法才能将杂质除掉。只要这样才能够理解每一步所加试剂或操作的意图。
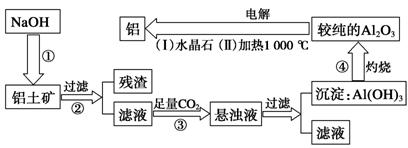
因为Al2O3是两性氧化物,而杂质SiO2是酸性氧化物,Fe2O3是碱性氧化物,因此可规划出两种提纯氧化铝的方案。 方案一:碱溶法
2.判别下列说法是不是正确,正确的划“√”,过错的划“×” (1)铝制容器可盛装浓H2SO4 () (2)日用铝制品外表覆盖着氧化膜,对内部金属起维护效果 () (3)明矾水解构成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 ()
3.(2011.上海归纳,10)世界上一次性建成的最长高速铁路--京沪高铁,方案于2011年6月底通车。列车时速高达380公里,车厢大部分选用铝合金资料制造,是因为铝合金 A.比纯铝熔点高 B.具有比较生动的化学性质 C.各种成分在天然界中含量丰厚,简单获取 D.质量轻,强度大,抗腐蚀的才能比较强 高考题组三铝及铝制品的处理与运用
4.(2011.重庆理综,26)用于金属焊接的某种焊条,其药皮由大理石、水泥、硅铁等制造而成。 (1)Al的原子结构暗示图为____________;Al与NaOH溶液反响的离子方程式为 。 (2)30Si原子的中子数为____;SiO2的晶体类型为________。 (3)Al3+与Yn-的电子数相同,Y地点族各元素的氢化物的水溶液均显酸性,则该族氢化物中沸点最低的是__________________________________________________________。 (4)焊接过程中,药皮在高温下发生了熔渣和使金属不被氧化的气体,该气体是____________。 (5)经处理后的熔渣36.0 g(仅含Fe2O3、Al2O3、SiO2),参加足量稀盐酸,别离得到11.0 g固体;滤液中参加过量NaOH溶液,别离得到21.4 g固体;则此熔渣中Al2O3的质量分数为________。
5.[2010.山东理综-29(1)]对金属制造的产品进行抗腐蚀处理,可延长其惯例运用的寿数。 以下为铝材外表处理的一种办法: 铝材 ↓ 槽液 ①碱洗的意图是除掉铝材外表的天然氧化膜,碱洗经常有气泡冒出,其原因是____________________(用离子方程式标明)。为将碱洗槽液中的铝以沉积方式收回,最好向槽液中参加下列试剂中的________。 a.NH3 b.CO2 c.NaOH d.HNO3 ②以铝材为阳极,在H2SO4溶液中电解,铝材标明发生氧化膜,阳极电极反响式为________。取少数废电解液,参加NaHCO3溶液后发生气泡和白色沉积,发生沉积的原因是________。
6.(2009.上海,25)铁和铝是两种重要的金属,它们的单质及化合物有着各自的性质。 (1)在必定温度下,氧化铁能够与一氧化碳发生下列反响: Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) ①该反响的平衡常数表达式为:K=____________; ②该温度下,在2 L盛有Fe2O3粉末的密闭容器中通入CO气体,10 min后,生成了单质铁11.2 g。则10 min内CO的均匀反响速率为____________。 (2)请用上述反响中某种气体的有关物理量来阐明该反响已到达平衡状况: ①______________;②________________。 (3)某些金属氧化物粉末和Al粉在镁条的点燃下能够发生铝热反响。下列反响速率(v)和温度(T)的联系暗示图中与铝热反响最接近的是__________。 (4)写出氢氧化铝在水中发生酸式电离的电离方程式: ___________________________。 欲使上述系统中Al3+浓度添加,可参加的物质是_________________________________。 铝土矿锻炼金属铝的流程
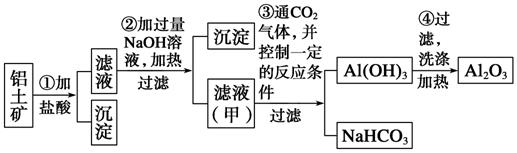
2、从铝土矿(首要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下: 请答复下列问题: (1)流程甲参加盐酸后生成Al3+的离子方程式为__________________________________。 (2)流程乙参加烧碱后生成SiO的离子方程式为________________________________。 (3)验证滤液B中含Fe3+,可取少数滤液并参加________(填试剂称号)。 (4)滤液E、K中溶质的首要成分是__________(填化学式),写出该溶液的一种用处:________________________________________________________________________。 (5)已知298 K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量的滤液B,参加必定量的烧碱到达沉积溶解平衡,测得pH=13.00,则此温度下残留在溶液中的c(Mg2+)=__________。
1.(1)×(2)√(3)√(4)×(5)√6)× 2.(1)√(2)√(3)√ 3.D
4.(1) 2Al+2OH-+2H2O===2AlO+3H2↑(2)16原子晶体(3)HCl(4)CO2(5)25%
5.①2Al+2OH-+2H2O===2AlO+3H2↑b ②2Al+3H2O-6e-===Al2O3+ 6H+ HCO与H+反响使H+浓度下降,发生Al(OH)3沉积
6.(1)0.015 mol.L-1.min-1 (2)①CO(或CO2)的生成速率与耗费速率持平 ②CO(或CO2)的质量不再改动(合理即给分) (3)b (4)Al(OH)3H++AlO+H2O盐酸(合理即给分)
