氮及其化合物在工农业生产、日子中有着重要使用,削减氮的氧化物在大气中的排放是环境保护的重要内容之一。
②必定温度下,在恒容密闭容器中充入必定量N2O5进行该反响,能判别反响已到达化学平衡状况的是______________。
![]()
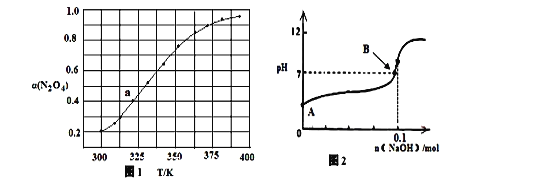
如图中a点对应温度下,已知N2O4的开始压强p0为200 kPa,该温度下反响的平衡常数Kp=________(小数点后保存一位数字,用平衡分压替代平衡浓度核算,分压=总压×物质的量分数)。
(4)将固体氢氧化钠投入0.1mol/L的HN3(氢叠氮酸)溶液傍边,溶液的体积1L(溶液体积改变忽略不计)溶液的pH改变如图所示,HN3的电离平衡常数K=1×10-5,B点时溶液的pH=7,核算B点时参加氢氧化钠的物质的量________mol(保存两位有用数字)。
![]()
(2)以Mn3O4为脱硝反响的催化剂,研究者提出如下反响进程,将进程弥补完好。
![]()
(3)T℃、2L密闭容器中,充入各1mol的CO和NO混合气体,参加Mn3O4产生脱硝反响,t0时到达平衡,测得反响过程中CO2的体积分数与时间的联系如下图所示:
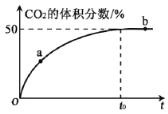
③NO的平衡转化率为______,T℃时反响的化学平衡常数K=_________。
④T℃时,某时间测得系统中各物质的量如下:n(CO)=0.2mol,n(NO)=0.2mol,n(N2)=0.1mol,n(CO2)=0.2mol,则此刻该反响_______进行(填“向正反响方向”“向逆反响方向”或“处于平衡状况”)。
【标题】含有C、H、O的化合物,其C、H、O的质量比为12∶1∶16,其蒸气相对于氢气的密度为58,它能与小苏打反响放出CO2,也能使溴水褪色,0.58g这种物质能与50mL0.2mol/L的氢氧化钠溶液彻底反响。试答复:
【标题】铝土矿的主要成分是Al2O33H2O,还含有SiO2、Fe2O3等杂质。工业上从铝土矿中提取Al可采用如图所示工艺流程。(部分操作称号及反响条件已省略)
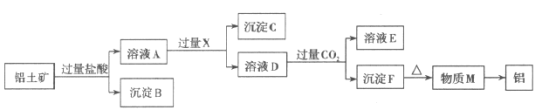
(3)D中的溶质是___,通入CO2后生成F的化学方程式是___,F的一种用处是___。
(4)由M生成铝的化学方程式是___,当有5.4g铝生成时,搬运电子___mol。
在50 mL酸式滴定管中装入盐酸,调整初始读数为30.00 mL后,将剩下盐酸放入锥形瓶
![]()
称取KMnO4固体0.158 g,放入100 mL容量瓶中,加水溶解并稀释至刻度
【标题】在373K时,把0.5 mol N2O4气体通入体积为5 L的真空密闭容器中,当即呈现红棕色。反响进行到2 s时,NO2的浓度为0.02 mol/L。在60 s时,系统已到达平衡,此刻容器内压强为反响前的1.6倍。下列说法正确的是
A.前2 s,以N2O4浓度改变表明的均匀反响速率为0.01 mol·L-1·s-1
![]()
,为探求氯气的性质,某同学使用此原理制氯气并规划了如图所示的试验设备。

(1)上述制备氯气的反响中,每生成1molCl2,搬运的电子的物质的量是________mol。
(2)根据上述反响原理,从下列设备中挑选正真合适的制氯气设备(A处)________(填序号)。

(3)设备B、C中顺次盛放的是枯燥的赤色布条和湿润的赤色布条,其意图是________。试验过程中该同学发现设备B中的布条也褪色,阐明该设备存在很明显的缺点,改善的办法是________。
(4)E中NaOH溶液吸收氯气时产生反响的化学方程式是________。
